肝細胞癌(Hepatocellular Carcinoma, HCC)是全球範圍内最常見的惡性腫瘤之一,占所有肝癌病例的90%以上。HCC 的早期症狀不明顯,大多數患者在确診時已處于疾病晚期,治療選擇有限,預後較差。目前,HCC 的主要治療方法包括手術切除、肝移植、局部消融和系統治療等。然而,由于 HCC 的高度異質性和複雜的生物學行為,這些治療方法的療效往往不盡如人意。近年來,免疫治療在 HCC 的治療中取得了顯著進展,尤其是免疫檢查點抑制劑的應用,為 HCC 患者帶來了新的希望。然而,盡管免疫檢查點抑制劑(如抗PD-1療法)和靶向藥物在晚期HCC治療中取得進展,但患者響應率差異顯著,亟需探索新的治療靶點以改善療效。
近年來,蛋白質翻譯後修飾(PTM)在腫瘤發生中的作用備受關注,其中SUMO化(SUMOylation)作為一種可逆的修飾過程,通過調控蛋白穩定性、互作能力及亞細胞定位參與癌症進展。SUMO特異性蛋白酶家族(SENPs)負責去SUMO化修飾,SENP3 是 SUMO 特異性肽酶家族的一員,能夠去除蛋白質上的 SUMO 修飾,從而調節蛋白質的功能。SENP3 在多種癌症中表達異常,包括肝細胞癌、乳腺癌、前列腺癌和結直腸癌等。然而,SENP3 在 HCC 中的具體作用及其分子機制尚不完全清楚。
在最新的研究中,伟德官网手机版江春平/吳俊華團隊發現,SENP3在HCC中顯著高表達,并通過調控腫瘤細胞内在惡性表型和重塑免疫微環境雙重機制促進肝癌進展。更關鍵的是,靶向抑制SENP3不僅抑制腫瘤生長,還可顯著增強抗PD-1療法的效果,該研究為HCC治療提供了全新策略。
這項研究首先通過Kaplan-Meier 生存分析及TCGA 和 ICGC 數據庫的分析發現 SENP3 在 HCC 組織中的表達水平顯著高于正常肝組織,緊接着研究團隊通過 qPCR , Western blot 以及免疫組化(IHC)實驗對臨床樣本進行分析證實,SENP3在HCC組織中顯著高表達,且與患者預後不良密切相關,這都揭示了SENP3在HCC惡性進展中發揮重要作用(圖1)。

圖1. SENP3 在 HCC 組織中高表達并與患者生存率負相關
研究團隊對SENP3 在 HCC 中的具體作用進行深入的探究。首先通過多種體外功能實驗揭示了敲低SENP3可抑制肝癌細胞的增殖、遷移和侵襲能力,并促進肝癌細胞凋亡;而過表達SENP3則加劇惡性表型(圖2)。随後,在多種小鼠模型(皮下移植瘤、肺轉移模型和原位肝腫瘤模型)中對SENP3的具體作用進行體内實驗驗證,結果顯示SENP3的缺失顯著抑制腫瘤生長和轉移(圖3)。體内和體外實驗共同證明了SENP3是HCC惡性進展的關鍵驅動因子及其是腫瘤生長和轉移中的關鍵因子。
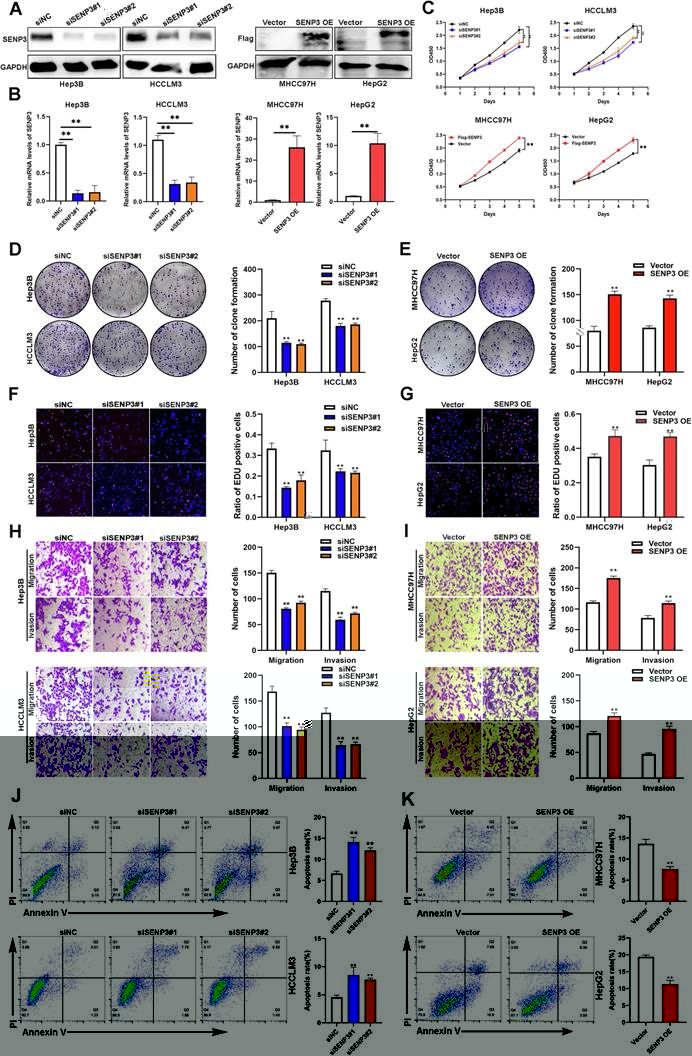
圖2. SENP3 在體外促進 HCC 細胞惡性表型的形成

圖3. SENP3 在體内促進 HCC 的生長和轉移
研究團隊緊接着對SENP3在HCC中的具體作用機制展開了研究,通過一系列實驗,研究團隊發現SENP3能夠直接與RACK1結合,并且能夠去除RACK1上的SUMO2/3修飾,特别是RACK1的K264和K271位點。這一去SUMO化作用增加了RACK1的穩定性,并促進了RACK1與PKCβII的相互作用,從而影響下遊信号通路的激活(圖4)。團隊進一步探讨了SENP3對RACK1穩定性和功能的影響。實驗結果顯示,SENP3的表達水平能夠調節RACK1的蛋白穩定性,敲低SENP3會導緻RACK1的泛素化增加,從而加速其降解,而SENP3過表達則相反。此外,SENP3通過去SUMO化修飾RACK1,增強了RACK1與PKCβII的結合,從而促進了eIF4E的磷酸化和相關癌基因的翻譯,進一步推動了HCC細胞的惡性表型(圖5)。此外,SENP3-RACK1軸還通過調控核糖體功能增強腫瘤細胞的代謝适應性。

圖4. SENP3解除了SUMO2/3對RACK1的控制

圖5. SENP3 可促進 RACK1 的穩定性及其與 PKCβII 的相互作用
團隊進一步研究發現,腫瘤内源性SENP3通過促進腫瘤相關巨噬細胞(TAMs)的浸潤來重塑免疫微環境,從而抑制抗腫瘤免疫反應。在免疫健全小鼠中,SENP3敲低顯著抑制了腫瘤生長并延長了總體生存時間,而在免疫缺陷小鼠中上述效果較弱。流式細胞術分析顯示,SENP3敲低減少了TAMs的浸潤,同時增加了CD8+ T細胞和NK細胞的數量,而SENP3過表達則相反。此外,巨噬細胞的缺失可以逆轉SENP3介導的腫瘤促進作用,進一步證實了SENP3通過招募TAMs來促進腫瘤生長(圖6)。同時,研究團隊也揭示了SENP3通過上調CCL20的表達來促進TAMs的招募,從而重塑免疫微環境。在實驗中,SENP3敲低顯著降低了CCL20的蛋白水平,而SENP3過表達則顯著增加了CCL20的蛋白水平。此外,SENP3主要通過調節CCL20的翻譯效率來影響其蛋白水平,而不是通過mRNA水平。過表達RACK1可以部分恢複SENP3敲低對CCL20分泌的影響,這表明SENP3通過RACK1依賴的方式調節CCL20的翻譯過程(圖7)。

圖6. 腫瘤内源性 SENP3 通過促進 HCC 中腫瘤相關巨噬細胞的浸潤來重塑免疫微環境

圖7. SENP3 通過上調 CCL20 表達促進腫瘤相關巨噬細胞的募集
最後,研究團隊發現在化學誘導的HCC模型中,肝特異性敲低SENP3顯著減少腫瘤數量和體積。聯合使用SENP3抑制劑與抗PD-1抗體可顯著增強療效,相較于單一治療組,聯合治療組腫瘤體積縮小超過60%。這一協同效應歸因于SENP3抑制後TAMs減少和CD8+ T細胞活性增強,從而重塑腫瘤免疫微環境(圖8)。

圖8. 靶向 SENP3 抑制 HCC 的進展并增強抗 PD-1 治療的療效
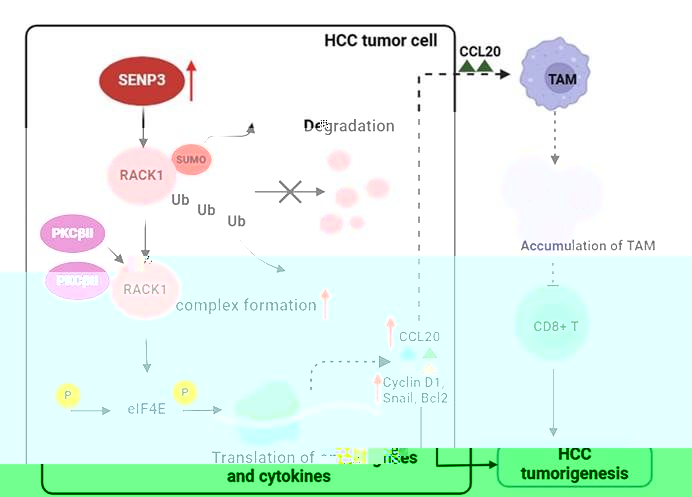
圖8K. 本研究的主要發現與模式機制圖,揭示了SENP3/RACK1軸驅動HCC進展與免疫逃逸的機制
本研究首次揭示了SENP3在HCC中的雙重作用機制,發現 SENP3 通過促進腫瘤相關巨噬細胞(TAMs)的浸潤和重塑免疫微環境,增加腫瘤微環境(TME)中調節性 T 細胞(Treg)的浸潤,從而抑制抗腫瘤免疫反應。該研究不僅闡明了SUMO化修飾在HCC中的新機制,還創新性地将腫瘤細胞内在信号與免疫微環境調控相結合,為聯合治療提供了重要靶點。
近日,伟德官网手机版江春平教授/吳俊華教授團隊在Cell Death & Differentiation上發表了題為“SENP3 inhibition suppresses hepatocellular carcinoma progression and improves the efficacy of anti-PD-1 immunotherapy”的研究論文。伟德官网手机版博士生汪鵬和博士畢業生仇建南等人為該研究論文的共同第一作者。伟德官网手机版江春平教授、吳俊華教授和王忠夏副主任醫師等人為該論文的共同通訊作者。該研究得到了國家自然科學基金(82772819、81972888)、省實驗室項目(編号SY5202202、JNL-202219B、JNL-202204A以及JNL-2023017D)及省重點研發計劃(BE2022840)的資助。
原文鍊接:https://doi.org/10.1038/s41418-024-01437-9
文章來源:南京大學官網
