胰腺導管腺癌(Pancreatic ductal adenocarcinoma,PDAC)是一種高度轉移性疾病,所有的靶向和免疫療法都很難治愈。盡管PDAC的早期診斷以及治療方法取得了進展,但由于早期診斷時,甚至在進行手術治療之後,發生遠端轉移的幾率很高,所以PDAC患者的預後極差。腫瘤内部的高度異質性以及複雜的腫瘤微環境被廣泛認為是有效治療PDAC患者的主要障礙。由于大多數PDAC 患者的轉移組織無法通過手術切除獲得,這些研究隻通過内鏡超聲引導下細針穿刺抽吸術(endoscopic ultrasound-guided fine needle aspiration,EUS- FNA) 收集有限的轉移組織活檢,因此阻礙了對轉移性PDAC的整個腫瘤微環境的綜合理解和評估。
南京大學呂瑛等研究人員對4名經病理診斷為PDAC并伴有肝轉移的患者的8個新鮮組織進行了單細胞轉錄組測序,并且對公共數據庫進行了深入挖掘。
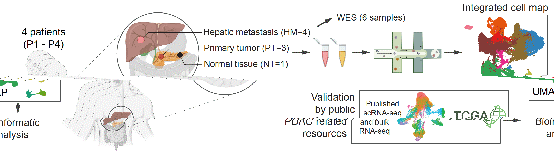
研究人員首先對上皮細胞進行了深入的分析,通過重新聚類分析,得到了6個上皮細胞亞群。發現第0簇ECs(RPS3+)主要存在于正常組中,而其他四個亞群主要存在于腫瘤組織中。通過染色體拷貝數變異分析發現在正常組織中幾乎沒有觀察到CNV事件,而轉移組CNV水平最高,并且每個上皮細胞亞群中CNVhigh細胞的百分比與該群中HM細胞的百分比呈正相關。與TCGA數據庫聯合分析發現,第2簇(CEACAM6+)和第3簇(CEACAM5+)上皮細胞亞群是惡性程度較高的細胞群。
研究人員進一步探索了PDAC患者的胰腺上皮細胞從原發腫瘤到轉移腫瘤的分化動态,即軌迹①:從PT組織的高增殖但低CNV狀态到HM組織的惡性且CNVhigh狀态。并且,發現了一個促進PDAC進展和轉移的惡性基因集,如KLK7、LITAF 和SPRR1B。
研究人員後續對基質細胞和免疫細胞也展開了深入的分析,确定了幾個基質細胞和免疫細胞的特定亞型,包括RGS5+腫瘤相關成纖維細胞、CCL18+脂質相關巨噬細胞、S100A8+中性粒細胞和FOXP3+調節性T細胞,對肝轉移腫瘤中促腫瘤微環境的形成至關重要。細胞相互作用分析進一步顯示,轉移性組織中缺乏腫瘤-免疫細胞的相互作用,有助于形成免疫抑制性微環境。
綜上,該研究首次繪制了同步切除的胰腺導管腺癌原發腫瘤和與之相匹配的肝轉移瘤的單細胞轉錄組圖譜,發現了上皮細胞在肝轉移腫瘤中表現出與原發腫瘤不同的轉錄組特征,并且從原發腫瘤到肝轉移腫瘤有明确的分化軌迹;确定了幾個基質細胞和免疫細胞的特定亞型對肝轉移腫瘤中促腫瘤微環境的形成至關重要;發現了幾個可能與PDAC轉移和不良預後相關的新型标志物,如KLK7、LITAF 和SPRR1B;細胞相互作用分析進一步顯示,轉移性組織中缺乏腫瘤-免疫細胞的相互作用,有助于形成免疫抑制性微環境。
2023年08月23日,伟德官网手机版附屬鼓樓醫院呂瑛教授、鄒曉平教授同生命科學學院陳迪俊教授、闫超教授合作在Nature Communications雜志在線發表了題為Single cell transcriptomic analyses implicate an immunosuppressive tumor microenvironment in pancreatic cancer liver metastasis的研究論文。該研究對PDAC配對的原發性和轉移性腫瘤樣本的腫瘤微環境中不同細胞成分和功能表型進行了全面的描述,不僅促進了對轉移性PDAC的免疫抑制微環境機制的深入理解,并可以作為設計新型靶向治療的寶貴資源,為提高PDAC肝轉移患者的生存率奠定基礎。伟德官网手机版附屬鼓樓醫院消化科呂瑛教授、鄒曉平教授、生命科學學院陳迪俊教授、闫超教授為本文的共同通訊作者。伟德官网手机版附屬鼓樓醫院張舒博士、生命科學學院博士生方雯、江蘇大學博士生周思琦、蘇州大學附屬第一醫院朱東明主任以及南京大學生命科學學院碩士生陳瑞東為本文的共同第一作者。

